--- title: Azoto author: - Ana Pocinho - André Casaleiro date: 2024-02-28 tags: #utilidades --- # Azoto O azoto ou nitrogénio é um gás inerte que compõe 78% da atmosfera da Terra, em volume. Este é um elemento químico gasoso, não metálico, incolor e inodoro. É um elemento pouco reativo, pelo que em condições normais de pressão e temperatura não se combina com nenhum outro elemento e é incapaz de entrar em combustão. ## História Foi descoberto em 1772 em Edimburgo, Escócia, pelo cientista Daniel Rutherford enquanto escrevia a sua tese de doutoramento. Rutherford começou a estudar um gás que restava após reações de combustão, mesmo depois de todo o conteúdo carbónico ser retirado. Inicialmente, denominou-o “gás nocivo”, ao perceber que este não era suficiente para manter vida. Foi, mais tarde, o químico francês Antoine Laurent de Lavoisier que lhe atribuiu a designação de azoto entre 1775 e 1776. ## Ciclo do azoto O azoto é um dos elementos mais importantes para a vida, pois encontra-se na constituição das proteínas, ácidos nucleicos e outros constituintes celulares. Embora o azoto esteja presente na maioria da atmosfera terrestre, grande parte dos seres vivos não consegue tirar proveito deste gás devido à sua ligação N≡N, altamente energética e difícil de quebrar. Assim, é fundamental a transformação e reciclagem deste gás conhecido como ciclo do azoto. Este ciclo consiste num conjunto de processos em que o azoto circula entre plantas no solo, água, ar e todos os seres vivos, possuindo 4 etapas, iniciando com a fixação do azoto, posteriormente acontece a amonificação, seguida da nitrificação e por fim ocorre a desnitrificação. Primeiramente, a fixação de azoto permite converter o *N*<sub>2</sub> em qualquer uma das suas formas nitrogenadas. Podemos afirmar que existem 4 formas de fixação do azoto no solo, sendo possível por meio de reações químicas naturais (fixação atmosférica) através da ação de relâmpagos cujos têm a capacidade de, mediante a água e o oxigénio, gerar espécies químicas reativas aptas a atacarem o azoto formando *HNO*<sub>3</sub>, que se mistura com a água da chuva. A fixação pode decorrer, por outro lado, por reações químicas industriais (fixação industrial) por meio do processo Haber-Bosch, produzindo amónia, amplamente utilizada na indústria de fertilizantes. É possível ainda que a fixação do azoto se dê por processos biológicos, mediante da decomposição da matéria orgânica e excreção por seres vivos de produtos nitrogenados (como ureia, ácido úrico e amónia). Por fim, pode ocorrer a fixação biológica, considerada a mais importante, caracterizada pela assimilação de azoto atmosférico por alguns seres vivos, como as bactérias *Rhizobium*, que vivem associadas às raízes de leguminosas. Este processo referido anteriormente, efetua a redução do azoto em amónio (*N**H*<sub>4</sub><sup>+</sup>) e, de seguida, a conversão deste composto em nitrato (*N**O*<sub>3</sub><sup>−</sup>). Esta sequência de reações, apresentada em (1), é conhecida como nitrificação, sendo esta a principal forma de assimilação de azoto pelos vegetais. NH<sub>4</sub><sup>+</sup> → NO<sub>2</sub><sup>–</sup> → NO<sub>3</sub><sup>–\ (1)</sup> O nitrato não absorvido pelas plantas pode retornar então à atmosfera como azoto gasoso, através de um processo de redução por algumas bactérias anaeróbias, designado desnitrificação.[^4][^5] 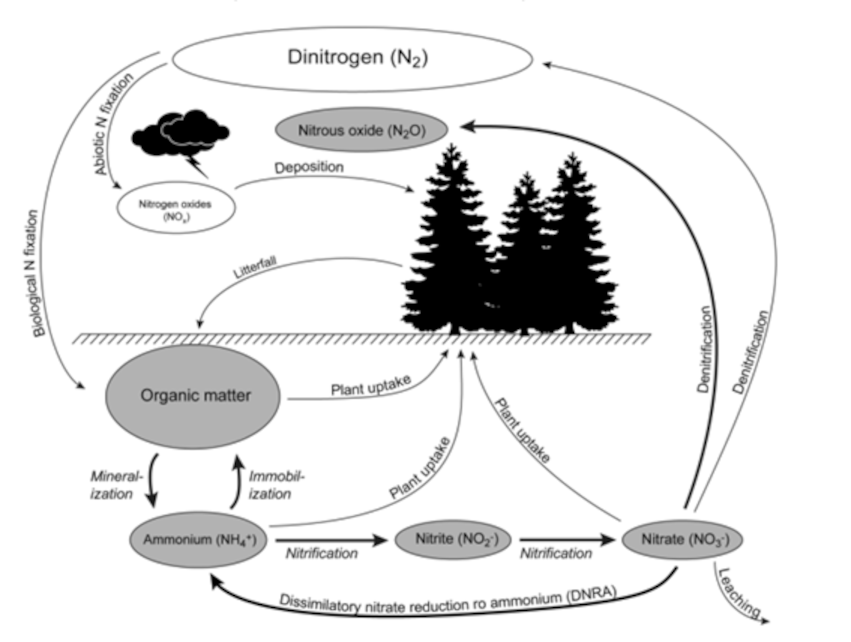 Figura 1: Ciclo do azoto em ecossistemas florestais.[^5] ## Formas de obtenção de azoto para utilização industrial O azoto não está disponível no seu estado puro uma vez que se encontra misturado com 21% de oxigénio e pequenas quantidades de outros gases.[^1] Uma vez que este gás não pode ser utilizado diretamente sem separação, existem dois tipos de obtenção de azoto: separação por membranas e o PSA (Pressure Swing Adsorption). ### Obtenção de azoto através da separação por membranas[^2] A obtenção de azoto por membrana é adequada para necessidades de produção deste gás de elevado fluxo no local. Este método utiliza um caudal com valores entre 1-1500 *N**m*<sup>3</sup>/h, permite um grau de pureza do gás obtido na gama dos 95% e 99,5%, possui um ponto de orvalho de -70’C e trabalha a uma pressão até 24 bar. O processo de separação por membrana utiliza o princípio das diferentes taxas de difusão dos gases através das fibras da membrana. Os gases que se difundem a uma taxa mais rápida, como o vapor de água e o oxigénio, são expulsos através da porta de ventilação. O gás que se difunde a uma taxa mais lenta, o azoto, continua através dos poros da membrana e sai como gás produto na extremidade da membrana. 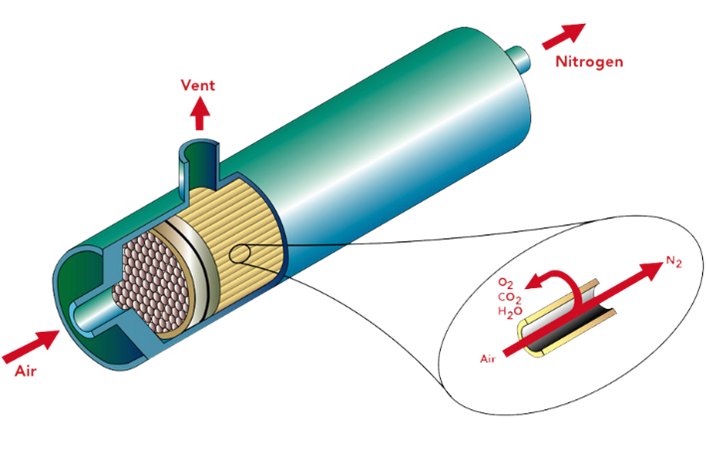 Figura 2- Esquema da separação do azoto por membrana.[^2] O cálculo da produção ideal de azoto a partir de membranas é complexo, dependendo de vários fatores, incluindo a queda de pressão através da membrana, a temperatura e fluxo volumétrico do ar de alimentação e a pureza desejada na saída. - Obtenção de azoto através da adsorção por variação de pressão (PSA)[^3] A obtenção de azoto por PSA é adequada para quando os requisitos de produção de gás são possuir um elevado valor de pureza e elevado fluxo. Estes geradores trabalham com um intervalo de caudal entre 1-1500 *N**m*<sup>3</sup>/h, um grau de pureza entre 98% e 99,999%, possuem um ponto de orvalho na gama dos -60’C e -80’C e trabalham à pressão de 5 bar, porém com um compressor de reforço opcional conseguem operar a pressões mais altas. Este processo utiliza colunas de CMS (Carbon Molecular Sieve) para extrair o azoto do ar. Consiste em 2 recipientes preenchidos com peneiras moleculares de carbono e alumina ativada. O ar comprimido limpo passa por um dos recipientes, o azoto puro sai como gás produto e o gás de exaustão, oxigénio, é libertado para a atmosfera. Após um curto período a gerar azoto, ocorre a saturação do leito da peneira molecular e, por meio de válvulas automáticas, o processo de produção de azoto passa para a outra coluna. Isto permite que o leito saturado passe por regeneração através de despressurização e purga para a pressão atmosférica. Assim, é possível que os dois recipientes alternem continuamente a produção de azoto e a regeneração, garantindo que o gás esteja sempre disponível para o seu processo. De seguida, apresentamos um vídeo explicativo acerca dos dois métodos de obtenção de azoto, sobre as suas características, modo de operação e vantagens de cada um. <video width="600" controls preload="auto"> <source src="./video1.webm" type="video/webm"> </video> Métodos de obtenção de azoto para utilizações industriais. ## Utilização do azoto na indústria Apesar da sua caraterística de baixa reatividade em condições normais de pressão e temperatura, o azoto tem um papel que se considera quase único no contexto industrial visto ser uma molécula com propriedades inertes e versáteis que tornam este gás essencial a diversos tipos de indústria.[^6][^7] As principais aplicações do azoto na indústria incluem: ### Ação como fertilizante O azoto tem a capacidade de ser um nutriente essencial para as plantas, sendo a base para a produção de fertilizantes nitrogenados. Este gás como o conhecemos não pode ser absorvido diretamente pelas plantas, por isso é convertido em amónia, essencial para esta produção. O método de produção industrial de amónia é conhecido como Haber-Bosch, em alusão aos seus criadores. ### Criação de ambientes inertes Determinadas indústrias necessitam de equipamentos industriais, como reatores químicos ou tanques de armazenamento, que requerem atmosferas anóxicas sendo injetado azoto de forma a diminuir progressivamente a concentração de oxigénio no meio, tornando a atmosfera inerte. Com isto, forma-se um ambiente capaz de preservar a integridade e qualidade de materiais e de proteger produtos da contaminação e principalmente da oxidação. O azoto na sua forma líquida é um refrigerante de ampla utilização, por exemplo na indústria alimentar e de bebidas, para congelamento e transporte de alimentos, ajudando a manter a frescura desses produtos por um período mais longo. Mais concretamente sais nitrito e nitrato são utilizados como aditivos alimentares em carnes, já que auxiliam na sua conservação e fixação da cor. ### Redução de riscos de incêndio e explosão Como sabemos, a reação de combustão de qualquer tipo material só ocorre se houver presença de oxigénio no ambiente. Considerando este facto utiliza-se o azoto como “manta protetora” em locais como tanques de armazenamento, onde o gás forma uma camada protetora de forma a isolar os produtos armazenados de atmosferas consideradas perigosas e assim prevenir acidentes como incêndios ou explosões. Um exemplo é a indústria de lâmpadas elétricas, em que o filamento de tungsténio aquecido da lâmpada evita a combustão devido à presença de azoto gasoso que substitui o ar cheio de oxigénio. ### Actuação como gás de purga A purga é um método fundamental de inertização na indústria utilizado nas correntes de processos que requerem este tipo de limpeza. É um método essencial para fornecer segurança e maior eficiência das operações industriais e baseia-se na remoção de ar, humidade e outro tipo de contaminantes que estejam presentes em tubagens, e é normalmente utilizado antes do início das operações de forma a garantir que as correntes estejam livres de contaminantes. O azoto é um dos principais gases de purga utilizados para este efeito devido às suas propriedades inertes, à sua abundância na nossa atmosfera sendo um dos gases mais fáceis de obter com este tipo de caraterísticas e pela sua elevada eficiência neste tipo de funções, sendo um exemplo de aplicação a indústria química. ## Limitações na utilização do azoto na indústria Os compostos de azoto são conhecidos pelo seu potencial explosivo, uma vez que estão presentes no trinitrotolueno (TNT) e na nitroglicerina. Por exemplo, em 2020, mais especificamente dia 4 de agosto, um incêndio no porto da cidade de Beirute, capital do Líbano, provocou a explosão de uma carga de nitrato de amónio (rico em azoto), cuja utilização seria para fabricação de fertilizantes.[^4] Outro problema associado ao azoto está relacionado com possíveis falhas nos equipamentos em que é armazenado. Usualmente, este gás é armazenado na fase gasosa, em garrafas de alta pressão e caso haja falhas neste equipamento que libertem o gás para um ambiente com défices de circulação de ar, vai provocar uma diminuição da concentração de oxigénio na atmosfera criando um ambiente anóxico podendo causar sintomas como fadiga, tonturas ou asfixia.[^8] ## Referências [^1]: MVS Engineering. “Various nitrogen gas uses for industrial purposes”, Disponível em: <https://www.mvsengg.com/blog/various-nitrogen-gas-uses-for-industrial-purposes> [Consultado em 21/02/2025] [^2]: MVS Engineering. “PSA Nitrogen Generator”, Disponível em: <https://www.mvsengg.com/products/nitrogen/psa-nitrogen/> [Consultado em 23/02/2025] [^3]: MVS Engineering. “Membrane Nitrogen Generator”, Disponível em: <https://www.mvsengg.com/products/nitrogen/membrane-nitrogen/> [Consultado em 23/02/2025] [^4]: Mundo Educação. “Nitrogénio”, Disponível em: <https://mundoeducacao.uol.com.br/quimica/nitrogenio.htm> [Consultado em 21/02/2023] [^5]: Björsne, A.-K., “The Nitrogen Cycle in Soil – Climate Impact and Methodological Challenges in Natural Ecosystems” (2018), University of Gothenburg. [^6]: LINDE Gas. “Drying, Inerting, Blanketing & Purging. Protect Chemicals in Storage and Pipelines”. Disponível em: <https://www.linde-gas.com/industries/chemical/industrial-service-solutions/drying-inerting-blanketing-purging>. [Consultado em 23/02/2025] [^7]: Reinhardt, H.-J., Himmen, H.-R., “Inerting in the chemical industry” , Linde AG, abril, 2010. Disponível em: <https://static.prd.echannel.linde.com/wcsstore/DE\_REC\_Industrial\_Gas\_Store/Assets/anwendungen/White-paper-Inerting-chemical-industry-Englisch.PDF> [Consultado em 23/02/2025]. [^8]: Air Liquide. “Quais são os perigos do azoto?” Disponível em: <https://pt.airliquide.com/solucoes/processos-de-gas-para-montagem-eletronica/quais-sao-os-perigos-do-azoto> [Consultado em 25/02/2025]
